Aktuelle Infos
Modul 4 - Ausbreitung von Pathogenen zwischen Bienenvölkern
Verantwortung
Prof. Dr. R. Moritz, Halle
r.moritz@zoologie.uni-halle.de
Prof. Dr. R. Paxton, Halle
robert.paxton@zoologie.uni-halle.de
Februar 2016
Abschlussbericht und Schlussbericht des Moduls 4
Mai 2014
Transmission von Pathogenen: standortspezifische Effekte und Koloniedichte
In diesem Modul soll die Interaktion von Pathogenen auf den Verflug und damit die Transmission von Pathogenen erfasst und untersucht werden. Zudem soll die Transmission durch die Betriebsweise erfasst werden.
Um den Effekt der Betriebsweise und Koloniedichte auf den Verflug zu determinieren, waren in 2013 Drohnen und Arbeiterinnen Proben von Bienenständen in und um Celle – FitBee Partner Prof. Dr. Werner von der Ohe (LAVES) - gesammelt worden. Mit Hilfe zweier weiterer FitBee Partner – namentlich Prof. B. Grünewald (Oberursel) und Dr. Christoph Otten (Mayen) – waren Drohnen und Arbeiterinnen von zusätzlichen Standorten in 2013 gesammelt worden. Dies ermöglicht es uns, viele Drohnensammelplätze in 2013 mit Variation bezüglich der Koloniedichte zu untersuchen, um den Zusammenhang zwischen Koloniedichte und Verflug und Krankheitsübertragung zu testen.
Im Sommer 2013 wurden Drohnen von vier Standorten in Deutschland in einem paarweisen Versuchsansatz gesammelt (Abbildung 1). An jedem Standort wurden zwei Drohnensammelplätze in einem Bericht mit hoher Völkerdichte und einem mit geringer Völkerdichte ausgewählt (der Minimalabstand zwischen den Standorten betrug 30 km). Von jedem Drohnensammelplatz (DCA) wurden 100 Drohnen gesammelt. Hierzu wurde synthetisches Königinnen-Pheromon in einer Wetterballon-Falle verwendet (Abbildung 2).
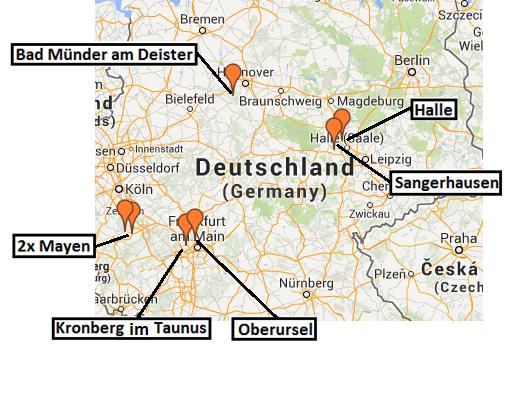
Abbildung 1. DCA Sammelorte: in Hannover konnte wetterbedingt nur an einer Stelle erfolgreich gefangen werden.

Abbildung 2. Drohnen werden von einem DCA mit Hilfe von einem mit Königinnen-Pheromon behandelten Fangnetz, das unter einen Wetterballon gehangen wird, gesammelt.
Die Koloniedichte jedes Sammelgebietes wurde mit Hilfe der Drohnen-Genotypen und durch Berechnung, aus wie vielen Völkern die Drohnen am Drohnensammelplatz stammen, bestimmt. Die geschätzten Völkerzahlen sind in Abbildung 3 dargestellt.
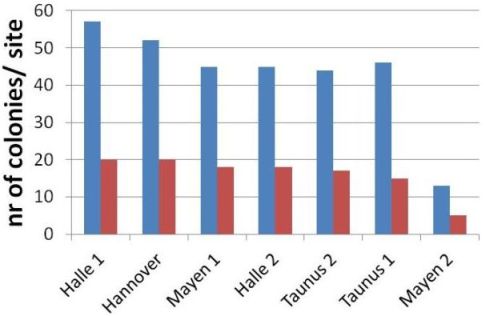
Abbildung 3. Geschätzte Völkerzahlen pro Standort (blau = maximale Schätzung, rot = minimale Schätzung).
Alle Drohnen wurden auf Pathogene untersucht, um ihren Gesundheitszustand festzustellen. Die Proben wurden auf zehn Virus-Arten (mittels MLPA; De Semt et al. 2012) und zwei Microsporidien (N. apis and N. ceranae) mittels rt-PCR getestet. Die am häufigsten gefundenen Virus-Arten waren: DWV/VDV/KV, BQCV, ALPV, and SBPV/SBV. Die gesamt Prävalenz jeder Virus-Art wird in Abbildung 4 gezeigt. N. apis and N. ceranae wurden nur in 4% und 2% der untersuchten Proben gefunden.
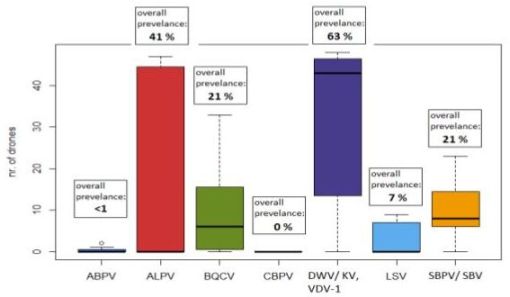
Abbildung 4. Anzahl infizierter Drohnen für die jeweiligen Viren (Stichprobenumfang je DCA N = 48, außer in Halle 1, N = 47).
Wir fanden einen signifikanten Effekt der Koloniedichte auf die Anzahl der Pathogenarten (GLMER: z = 2.673, P = 0.0075; auf Basis der minimalen Kolonieschätzung (Abbildung 5); z = 2.079, P = 0.0377 auf Basis der maximalen Kolonieschätzung nicht gezeigt).
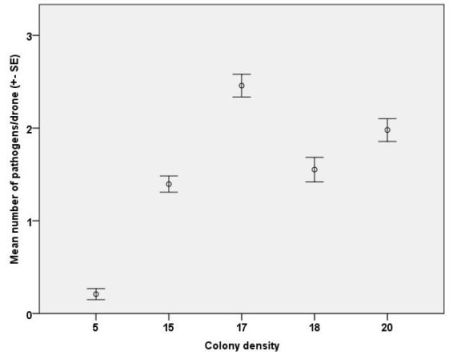
Abbildung 5. Die Anzahl der Pathogene je Drohne war signifikant mit der Koloniedichte korreliert (GLMER, p<0.001).
Die Koloniedichte war positiv mit der BQCV und SBPV/SBV Prävalenz in Drohnen korreliert (GLMER mit BQCV, minimale Koloniedichte, z = 4.333, P < 10-5; maximale Koloniedichte, z = 3.516, P = 0.0004; SBPV/SBV: minimale Koloniedichte, z = 2.714, P = 0.0066; maximale Koloniedichte, z = 2.863, P = 0.0042).
Diese Experimente und Beobachtungen lassen folgendes schlussfolgern:
- Hohe Koloniedichten führen zu einer erhöhten Pathogenprävalenz
- Die Verbreitung von BQCV und SBPV/SBV wird wesentlich von der Koloniedichte beeinflusst. In Gebieten mit erhöhter Imkerei-Aktivität und somit hoher Anzahl an Honigbienenvölkern, wird die Anfälligkeit oder Übertragung dieser Viren gefördert.
Oktober 2012
Hier finden Sie aktuelle Informationen (incl. Bilderserie) aus diesem Modul.
Text und Bilder gibt es auch als Download (PDF-Format).
Laufende / kürzlich abgeschlossene Aktivitäten
- Erstellung eines Schnelltestverfahrens für die Virusdiagnostik
- Erfassung des Verflug zwischen Bienenvölkern in Abhängigkeit von Virusinfektionen
- Erfassung der Koloniedichte durch Genotypisierung von Drohnen
- Erfassung der Pathogenprävalenz in Bienenpopulationen durch Diagnostik an Drohnen
- Erfassung des Einfluss der Imkerei auf die Bienengesundheit
Bisherige (Zwischen-)Ergebnisse und Erkenntnisse
- Alle Arbeiten sind noch im Gange und noch nicht abgeschlossen
- Untersuchungen von Völkern, die gegen Varroa behandelt und solchen, die nicht behandelt wurden, zeigen erhebliche Unterschiede bei der viralen Prävalenz – insbesondere bezüglich des Flügeldeformationsvirus (DWV). Ein Bild aus einer laufenden Untersuchung ist im Abschnitt „Bilder“ zu sehen.
Eine Genotypisierung der befallenen Bienen wird durchgeführt, um den Einfluss der Krankheitserreger auf Verflug zu bestimmen. - Zu Untersuchungszwecken mit Krankheitserregern infizierte Bienen werden in zweierlei Hinsicht auf Verhaltensänderungen beobachtet: innerhalb des Bienenstocks (Bild hierzu im Abschnitt „Bilder“) und in Hinsicht auf ihre Flugaktivität und Verflug.
Weitere Anmerkungen / Informationen
- Unsere vorläufigen Ergebnisse zeigen, dass Honigbienen aus natürlichen Gegebenheiten heraus mit zwei oder mehr Krankheitserregern infiziert sind (bspw. mit dem Flügeldeformationsvirus und Nosema cerana aus der Abteilung der Mikrosporidien. Die experimentelle Arbeit einer „FIT BEE“ -Projektmitarbeiterin (Myrsini Natsopoulou) legt nahe, dass Wechselwirkungen zwischen den Erregern zu einer verstärkten Beeinträchtigung des Verhaltens (z.B. Verflug zwischen Völkern) der Trägerbiene führen.
Bilder aus den Versuchsreihen


